თანამედროვე მედიცინა უდიდესი პარადოქსის წინაშე დგას. მიუხედავად იმისა, რომ ჩვენ გვაქვს უპრეცედენტო ცოდნა ადამიანის გენომისა და ბიოლოგიის შესახებ, მკურნალობის მეთოდები ჯერ კიდევ ჩამორჩება. სტატისტიკა სავალალოა: იმ დაავადებების გამომწვევი “სამიზნეების” (Targets) დაახლოებით 90%, რომელთა მკურნალობა თეორიულად შესაძლებელია, დღემდე რჩება ეფექტური მედიკამენტის გარეშე. მთავარი ბარიერი აქ არა იდეების ნაკლებობა, არამედ სიჩქარე და მასშტაბია. ტრადიციული მეთოდები, რომლებიც ლაბორატორიებში გამოიყენება, უბრალოდ ვერ ეწევა მონაცემთა იმ ზღვას, რომელსაც თანამედროვე მეცნიერება წარმოქმნის.
თუმცა, ჟურნალ Science-ში გამოქვეყნებული ახალი კვლევა გვამცნობს, რომ ეს რეალობა შესაძლოა წარსულს ჩაბარდეს. მკვლევართა ჯგუფმა, რომელსაც მხარს უჭერს Microsoft Research და Tsinghua University, შეიმუშავა რევოლუციური ჩარჩო — DrugCLIP. ეს არის ხელოვნური ინტელექტის ახალი მოდელი, რომელიც იყენებს ე.წ. კონტრასტულ სწავლებას (Contrastive Learning) და წამლების ვირტუალურ სკრინინგს 10 მილიონჯერ უფრო სწრაფს ხდის, ვიდრე დღეს არსებული სტანდარტული მეთოდები. ეს არ არის უბრალოდ რიცხვების თამაში; ეს არის ფუნდამენტური ცვლილება იმაში, თუ როგორ ვეძებთ ახალ მოლეკულებს კიბოს, გენეტიკური დაავადებებისა და ახალი ვირუსების წინააღმდეგ.
პრობლემა: მოლეკულური სირთულე
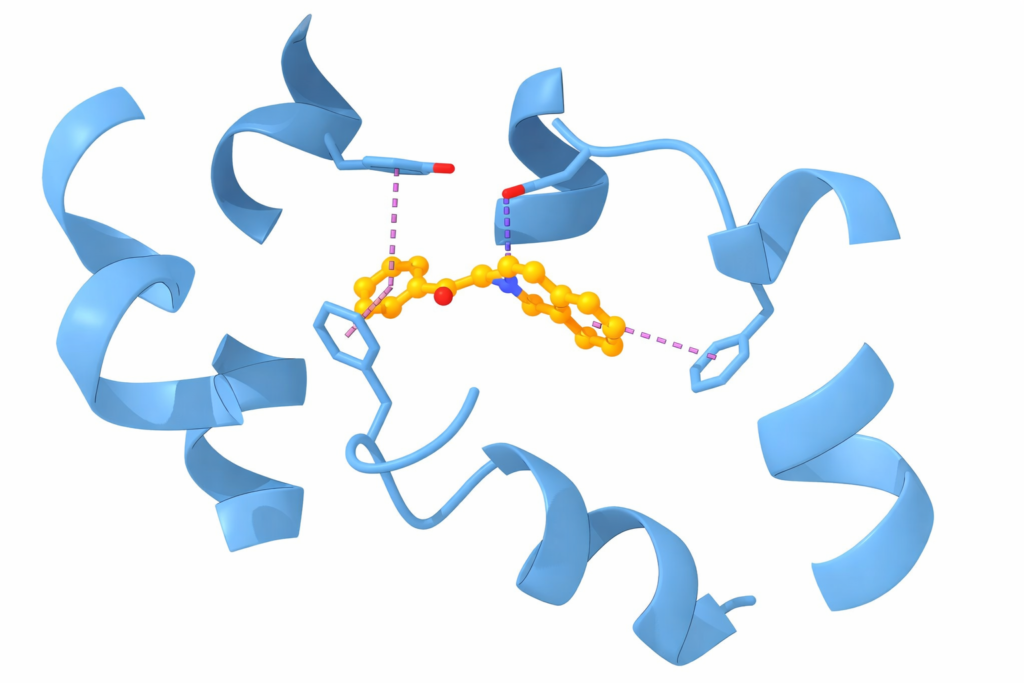
იმისათვის, რომ გავიგოთ DrugCLIP-ის მნიშვნელობა, ჯერ უნდა ავხსნათ, როგორ იქმნება წამალი ტრადიციული გზით. ეს პროცესი წააგავს გასაღების მორგებას საკეტზე. „საკეტი“ არის ცილა (Protein), რომელიც დაავადებას იწვევს, ხოლო „გასაღები“ არის მცირე მოლეკულა (Ligand), რომელმაც ეს ცილა უნდა დაბლოკოს ან გაააქტიუროს. მეცნიერები იყენებენ მეთოდს, რომელსაც მოლეკულური დოკინგი (Molecular Docking) ეწოდება. ეს არის კომპიუტერული სიმულაცია, რომელიც ცდილობს გათვალოს, როგორ დაუკავშირდება კონკრეტული მოლეკულა ცილას 3D სივრცეში.
პრობლემა ისაა, რომ ეს პროცესი კოლოსალურ გამოთვლით რესურსებს მოითხოვს. თითოეული მოლეკულის ცილასთან „შეხვედრის“ სიმულაციას დრო სჭირდება. როდესაც თქვენ გაქვთ მილიარდობით პოტენციური მოლეკულა და ათასობით ცილოვანი სამიზნე, მათი სათითაოდ შემოწმება (Genome-scale Screening) პრაქტიკულად შეუძლებელია. სწორედ ამიტომ, ფარმაცევტული კომპანიები ხშირად იძულებულნი არიან, შეზღუდონ ძიების არეალი, რის გამოც პოტენციურად გადამრჩენელი წამლები ყურადღების მიღმა რჩება.
DrugCLIP: გამოსავალი კონტრასტულ სწავლებაში
DrugCLIP-ის შემქმნელებმა პრობლემას სულ სხვა კუთხით შეხედეს. ნაცვლად იმისა, რომ ეცადათ ფიზიკური ინტერაქციის რთული სიმულაცია (რაც ნელია), მათ გამოიყენეს მიდგომა, რომელიც წარმატებით მუშაობს გამოსახულებებისა და ტექსტის დამუშავებაში (მაგალითად, OpenAI-ს CLIP მოდელი). DrugCLIP იყენებს კონტრასტულ სწავლებას, რათა ვირტუალური სკრინინგი აქციოს არა ფიზიკის ამოცანად, არამედ „ინფორმაციის მოძიების“ (Retrieval) ამოცანად.
სისტემა მუშაობს ორი ნეიროქსელის პარალელური გამოყენებით: ერთი ქსელი „სწავლობს“ და აკოდირებს ცილის სტრუქტურას (Protein Pocket), ხოლო მეორე — მცირე მოლეკულის სტრუქტურას. შემდეგ ეს ორივე ინფორმაცია გარდაიქმნება მათემატიკურ ვექტორებად საერთო სივრცეში. თუ ვექტორები ერთმანეთთან ახლოს არიან, ეს ნიშნავს, რომ მოლეკულა დიდი ალბათობით დაუკავშირდება ცილას. თუ შორს არიან — არა. ეს პროცესი მილიონჯერ უფრო მარტივია კომპიუტერისთვის, ვიდრე ატომების ფიზიკური შეჯახების სიმულაცია.
სისწრაფე, რომელიც ცვლის თამაშის წესებს
კვლევის შედეგები შთამბეჭდავია. ავტორების განცხადებით, DrugCLIP ახერხებს პოტენციური წამლების იდენტიფიცირებას 10 მილიონჯერ უფრო სწრაფად, ვიდრე ტრადიციული დოკინგის მეთოდები. პრაქტიკაში ეს ნიშნავს, რომ პროცესი, რომელსაც ადრე თვეები ან წლები სჭირდებოდა, ახლა შეიძლება დასრულდეს საათებში ან თუნდაც წუთებში. მაგალითად, DrugCLIP-ს შეუძლია დაასკანეროს მილიონობით მოლეკულა ათასობით სამიზნე ცილაზე თითქმის მყისიერად.
უფრო მეტიც, ეს სისწრაფე არ მოდის სიზუსტის ხარჯზე. საორიენტაციო ტესტებში (Benchmarks) მოდელმა აჩვენა უფრო მაღალი სიზუსტე, ვიდრე არსებულმა ღრმა სწავლების სხვა მეთოდებმა. განსაკუთრებით აღსანიშნავია მისი ეფექტურობა ე.წ. “Zero-shot” რეჟიმში, როდესაც სისტემას უწევს იმუშაოს ისეთ ცილებთან, რომლებიც მას სწავლების პროცესში არასდროს უნახავს. ეს კრიტიკულად მნიშვნელოვანია ახალი და უცნობი დაავადებების წინააღმდეგ ბრძოლაში.
AlphaFold-ის მემკვიდრეობა და პრაქტიკული შედეგები
DrugCLIP-ის წარმატება დიდწილად ეყრდნობა AlphaFold-ის რევოლუციას. რადგან AlphaFold-მა შეძლო თითქმის ყველა ცნობილი ცილის სტრუქტურის წინასწარმეტყველება, DrugCLIP-ს აქვს უზარმაზარი მონაცემთა ბაზა სამუშაოდ. კვლევის ფარგლებში, მეცნიერებმა სისტემა გამოსცადეს რეალურ ლაბორატორიულ პირობებშიც (Wet-lab validation). მათ წარმატებით იპოვეს ახალი ინჰიბიტორები ისეთი რთული სამიზნეებისთვის, როგორიცაა ნორეპინეფრინის გადამტანი და TRIP12 ცილა — ეს უკანასკნელი კი ისეთი სამიზნეა, რომლისთვისაც აქამდე წამალი არ არსებობდა.
DrugCLIP-ის გამოჩენა კიდევ ერთხელ ადასტურებს, რომ ბიოლოგია და ინფორმაციული ტექნოლოგიები განუყოფელი ხდება. თუ AlphaFold-მა გვაჩვენა ცილების სტრუქტურა, DrugCLIP გვაძლევს ინსტრუმენტს, რათა ამ სტრუქტურებზე ზემოქმედების მექანიზმები ვიპოვოთ. 10 მილიონჯერ აჩქარებული სკრინინგი ნიშნავს, რომ მეცნიერებს შეუძლიათ შეამოწმონ ბევრად უფრო თამამი ჰიპოთეზები, გამოიკვლიონ მოლეკულების უფრო ფართო სპექტრი და, საბოლოო ჯამში, შეამცირონ ის დრო, რაც სჭირდება პაციენტამდე ახალი წამლის მიტანას. ეს არის ნათელი მაგალითი იმისა, თუ როგორ გადადის ხელოვნური ინტელექტი თეორიული კვლევებიდან რეალურ, სიცოცხლის გადამრჩენელ პრაქტიკაში.დასკვნის სახით შევიძლია ვთქვათ რომ AI მედიცინა წარმოუდგენელი სისწრაფით ვითარდება და დიდი ალბათობით, უახლოეს თვეებში წარმოუდგენლად დადებით შედეგებს მოგვიტანს